Oracle: Desconfianza en datos de ensayos clínicos retrasa el desarrollo de fármacos
La costosa preparación de datos, su lenta reconciliación y la baja calidad de los mismos dificultan los esfuerzos en el desarrollo de medicamentos para terapias que salvan vidas
REDWOOD SHORES, Calif., 26 de septiembre de 2018 – Un nuevo estudio global, realizado por Oracle Health Sciences y Pharma Intelligence, reveló que el 57% de los investigadores clínicos encuestados cree que los problemas de datos clínicos dan lugar a retrasos en los ensayos. En este sentido, la encuesta también reveló que las compañías farmacéuticas comparten preocupaciones importantes sobre su capacidad de traer, con rapidez, más medicamentos al mercado debido a los desafíos de datos clínicos.
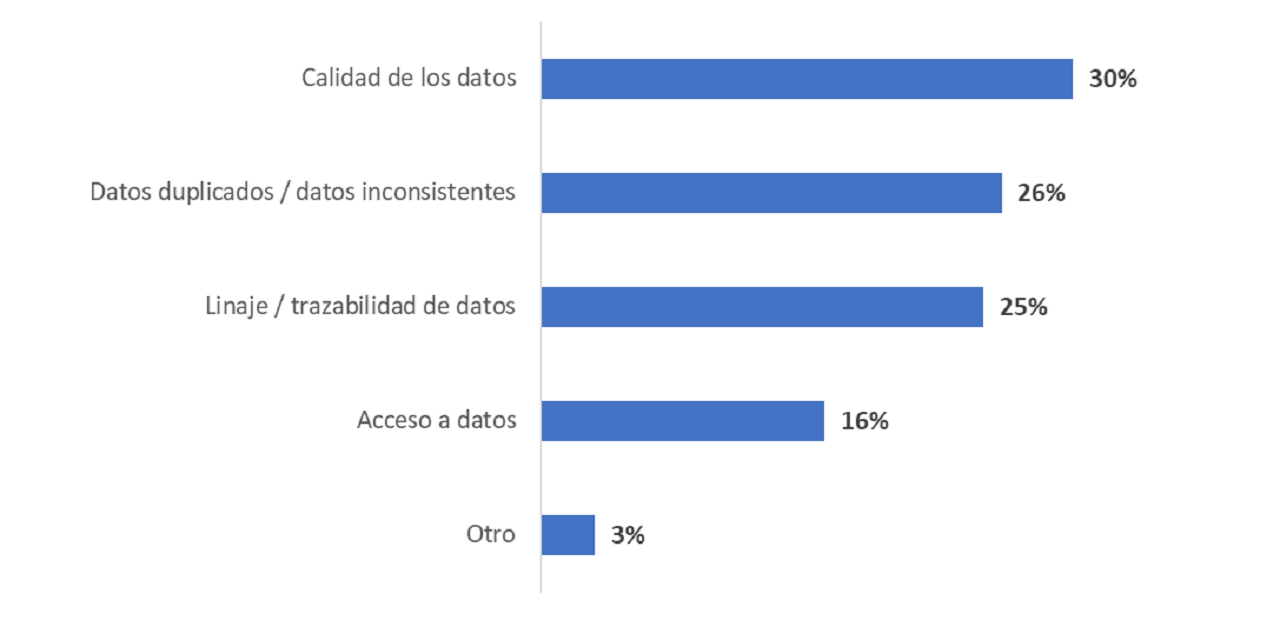
Además de los retrasos en las pruebas, el 81% de los encuestados mencionó los problemas de gobernabilidad de datos como el mayor desafío para cumplir con la normativa. Los tres principales problemas de datos según los encuestados fueron duplicación/inconsistencia, calidad, integridad y trazabilidad de los datos.
«La gobernanza de datos es nuestra principal preocupación porque los problemas de calidad de los datos clínicos pueden dificultar la finalización de un ensayo», dijo Melonie Longan, Directora de Operaciones de Datos y Servicios Funcionales de Premier Research – una compañía de investigación que atiende a clientes de biotecnología dedicados a la investigación de terapias relacionadas con analgesia, dermatología, hematología, oncología, neurociencia, pediatría y enfermedades raras.
Entre sus principales desafíos operacionales confesaron que el 51% se refiere a la integridad de los datos, el 45% a la calidad de los datos y el 43% a la limpieza de los mismos.
«El tipo de problemas de calidad de los datos clínicos, como los destacados en este informe, pueden tener impactos negativos significativos. Como compañía de datos, siempre estamos buscando formas de mejorar la calidad de los datos y procesarlos de manera eficiente para que los pacientes tengan acceso a los tratamientos lo más rápido posible «, dijo Julie Barenholtz, Directora Principal de Datos Clínicos de Cytel Inc. Fundada en 1987, Cytel es una organización de investigación por contrato (CRO) multinacional conocida por su trabajo pionero en ciencia estadística y el diseño e implementación de ensayos.
Como era de esperar, más de tres cuartas partes de los encuestados mencionaron a los datos inconsistentes y datos de pacientes desaparecidos como los problemas de datos clínicos más críticos para detectar en ensayos clínicos.
«Los equipos clínicos se ven obligados a pasar tiempo limpiando datos en lugar de analizarlos, y no siempre pueden ver la imagen completa de lo que está disponible para ellos; esto retrasa la capacidad de tomar decisiones críticas sobre el ensayo y mantiene la presentación reglamentaria», dijo Steve Rosenberg, Gerente General de Oracle Health Sciences. «Los investigadores clínicos no deberían tener que gastar tiempo y recursos en solucionar problemas de datos que la tecnología fue creada para manejar. La tecnología puede y debe usarse para eliminar la intervención manual innecesaria y mitigar el riesgo para que podamos poner las terapias en manos de los pacientes que están esperando «.
Los tres principales riesgos destacados por la investigación incluyen la necesidad de conciliación de datos adicionales; datos incompletos para determinar la eficacia y los reemplazos del paciente.
«Perder tiempo valioso reconciliando problemas de datos clínicos, puede ser perjudicial y costoso para nuestros clientes», dijo Vicki Gashwiler, Director Asociado de Desarrollo Estratégico y Acceso a Mercados, División MedTech para Novella Clinical. «Nuestra principal preocupación es la gestión y el control de datos proactivos para reducir el riesgo de que los problemas de calidad de los datos clínicos retrasen la prueba. Estas demoras pueden tener importantes implicaciones financieras para nuestros clientes «.
La encuesta fue realizada por Pharma Intelligence y patrocinada por Oracle Health Sciences y se ejecutó desde principios de agosto de 2018 hasta septiembre de 2018. El mayor porcentaje de respuestas provino de investigadores clínicos, científicos de datos y programadores clínicos de organizaciones biofarmacéuticas y un pequeño porcentaje de empresas de dispositivos médicos y organizaciones de investigación por contrato. Los encuestados provenían de todo el mundo, con un 61 por ciento de América del Norte, un 20 por ciento de Asia Pacífico y un 17 por ciento de Europa.
Recursos adicionales.
- Descarga el informe completo de investigación
- Aprende más sobre Data Management Workbench
- Únase al webcast en vivo con expertos de Oracle Health Sciences y Pharma Intelligence para comprender cómo evitar que problemas de calidad de datos interrumpan el progreso de los ensayos clínicos el 3 de octubre de 2018 a las 11:00 a.m. EDT